張貼時間:2021-03-04
版權為台灣醫藥品法規學會所有,公開引用請註明出處。
前言
全球之生物製劑技術發展快速,生物藥品之市場規模也隨之逐漸擴大。在2019年,全球之生物藥品規模約為2580億美元1,台灣在2019年於生物製劑之健保申報費用也已超過333億元2。近幾年來,許多生物藥品之專利權期陸續到期,為了降低生物製劑的高昂醫療花費,生物相似性藥品在台灣、歐美各國也逐步核准上市。台灣醫藥品法規學會期望能透過正確、即時的資訊傳遞,提昇各界對於本國生物相似性藥品最新現況之認識。
首期彙報內容主要涵蓋以下五點:
一. 目前台灣之生物相似性藥品總覽
二. 台灣生物相似性藥品之健保給付價格
三. 未來可能上市之生物相似性藥品
四. 生物相似性藥品由核准至健保給付所需時間
五. 未來十年使用生物相似性藥品替代生物製劑之花費預估
一. 目前台灣之生物相似性藥品總覽:
已獲藥品許可證之生物相似性藥品:截至2021.02.01,已獲得台灣食藥署藥品許可證之生物相似性藥品共有10個不同成份 (molecules),15個商品名,26個不同品項3,成分與詳細資訊列表如下表一。與其他國家比較,截至目前為止,美國FDA4共有29個商品名,歐盟EMA5共有60個商品名已獲核准。
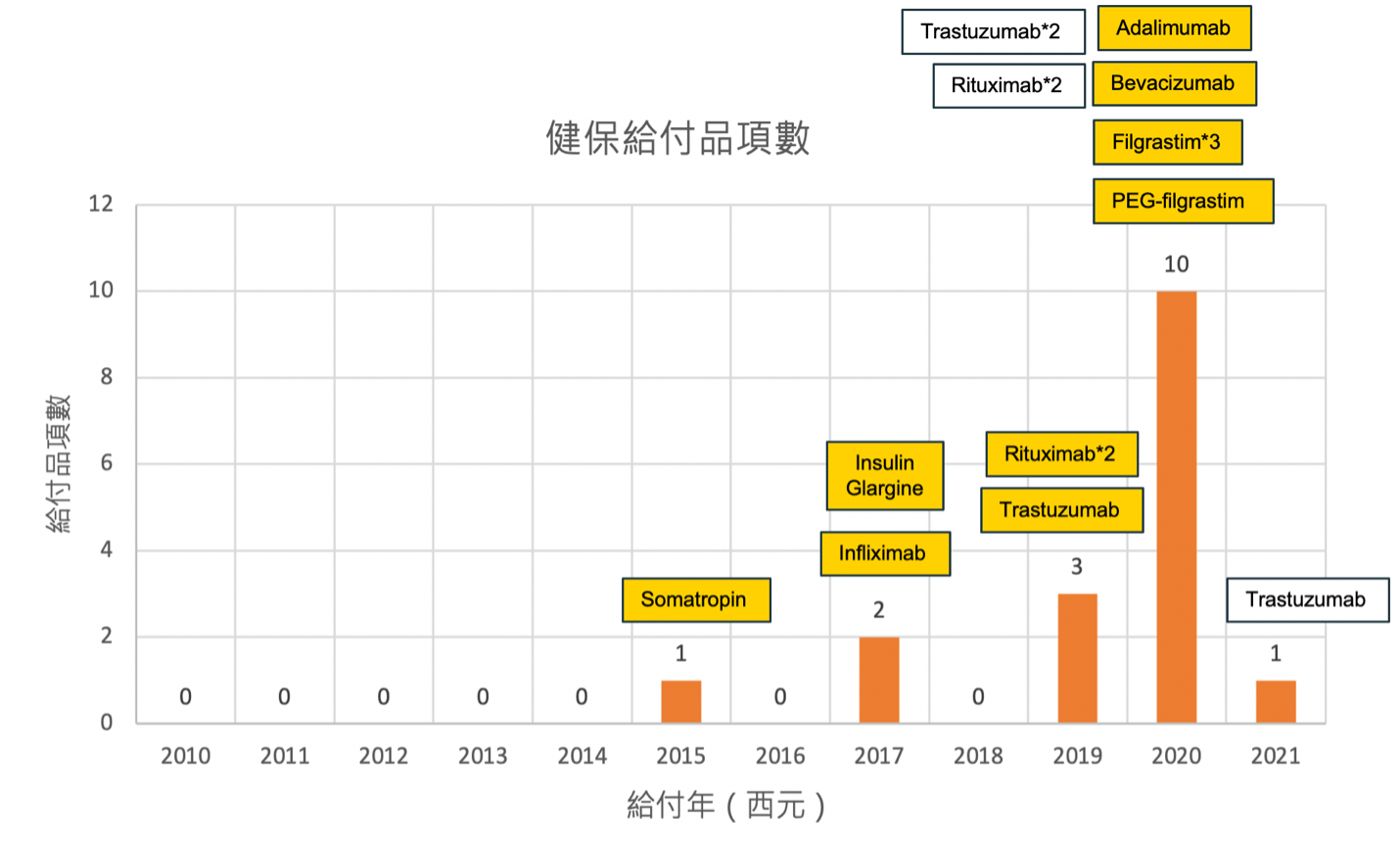
已獲健保給付之生物相似性藥品:截至2021.02.01,共有9個不同成分,13個商品名,17個品項已取得健保給付6,取得健保給付的時間軸如下圖一,於2020年一年間便給付了10個品項。目前唯一尚未取得健保給付的成份為etanercept,商品名為Erelzi。
圖一:台灣生物相似性藥品之健保給付時間軸
二. 台灣生物相似性藥品之健保給付價格
生物相似性藥品之健保核價方式,以全民健康保險藥物給付項目及支付標準第32-1條規範如下:
(一)、有收載同成分規格生物相似性藥品或原開發廠藥品或參考藥品者,取下列條件之最低價:
1. 本標準已收載原開發廠藥品或參考藥品最低價之○.八五倍。
2. 原開發廠藥品或參考藥品在十國藥價中位數最低價之○.八五倍。
3. 該藥品在十國藥價中位數之○.八五倍。
4. 已收載生物相似性藥品之最低價。
5. 廠商建議價格。
(二)、未收載同成分規格生物相似性藥品、原開發廠藥品及參考藥品者,取下列條件之最低價:
1. 本標準已收載原開發廠藥品或參考藥品最低價規格量換算後價格之○.八五倍。
2. 原開發廠藥品或參考藥品在十國藥價中位數最低價之○.八五倍。
3. 該藥品在十國藥價中位數之○.八五倍。
4. 已收載生物相似性藥品規格量換算後之最低價。
5. 廠商建議價格。
目前台灣健保給付價與目前原廠藥給付價之54%~98%之間,平均約為77%。若以成分別來看,Somatropin之折數為98%為最高,因為somatropin推出之時間為2010年,當時尚未有生物相似性藥品之概念,因此是以學名藥的方式核准上市,並於2015年給予核價。其次,Trastuzumab最低之價位為原廠之73%,Rituximab為66%,Filgrastim為54%。健保給付價受健保給付時間點之各國藥價、後續歷年健保藥價調整影響,與當初給付時預期的倍數有所差異。
三. 未來可能上市之生物相似性藥品
以美國FDA4及歐盟EMA5核准上市之生物相似性藥品商品名進行統計,截至2021.02.01為止,共有59 種生物相似性藥品商品名尚未出現在台灣。台灣尚無生物相似性藥品之成分共有 7種,14種商品名;台灣已有生物相似性藥品之成分共10種,45種商品,統計如下表三。
四. 生物相似性藥品由核准至健保給付所需時間
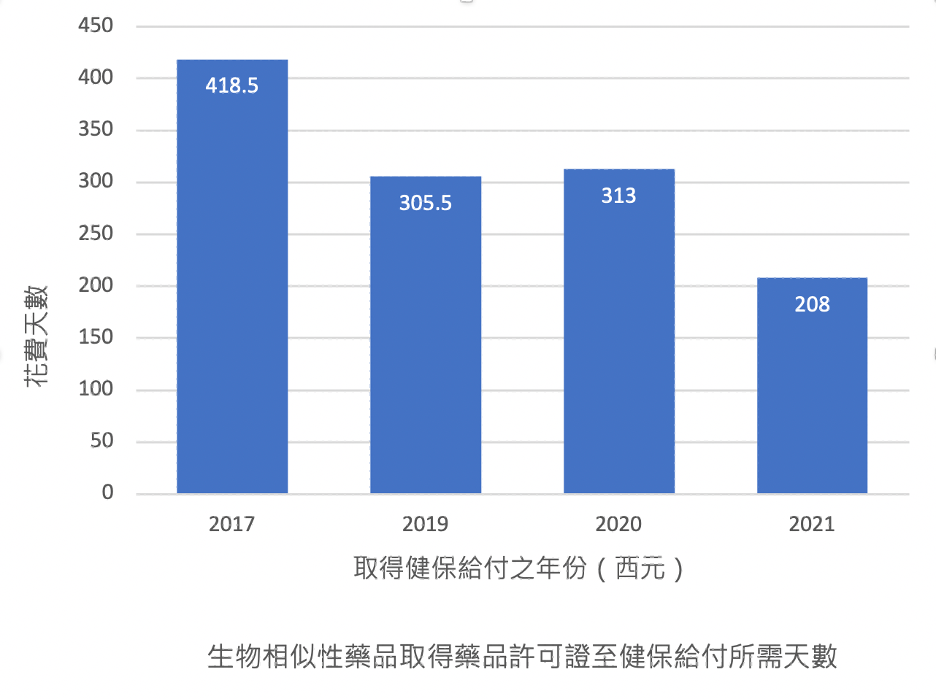
排除較早上市之somatropin,對所有台灣已有健保價之生物相似性藥品進行統計,觀察生物相似性藥品取得藥品許可證3之日到健保第一次核准給付之日6所需時間,平均為320 ± 143天,然可發現近幾年核准給付所需之時間逐年下降。統計如下圖二。
圖二 :生物相似性藥品取得健保給付所需時間統計
五. 未來十年使用生物相似性藥品替代生物製劑之花費預估
假設所有生物製劑未來皆可發展出生物性相似性藥品,且在台灣具有品項可使用,以目前生物性相似性藥品之價格平均77%,模擬不同替代率,進行未來十年間的節省花費預估。
2020年,生物製劑藥品之花費已超過每年333億台幣。2014-2020年,生物製劑總花費年均複合成長率為7.8%2,進行未來十年之生物製劑費用估算。統計2021-2030年間之總花費,並估算生物相似性藥品之可能節省如下表四。
若完全不使用生物性相似性藥品,約會花費5156億,如可將20%~80%替代為生物性相似性藥品,約可節省237億~949億,為數可觀。
表四: 預估未來十年使用生物相似性藥品替代生物製劑之節省花費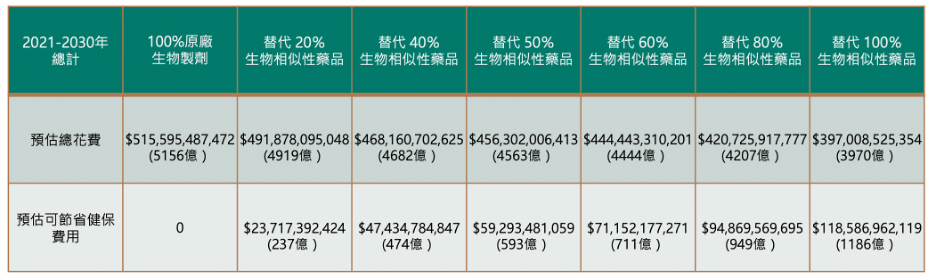
Reference:
1. 2020生技產業白皮書 - 經濟部生技醫藥產業發展推動小組,檢自 https://www.biopharm.org.tw/images/2020/Biotechnology-Industry-in-Taiwan-2020.pdf (Feb.01.2021)
2. 我國生物相似性藥品健保給付政策及面臨之挑戰 衛生福利部中央健康保險署-醫審及藥材組戴組長雪詠 (Jul.04.2020)
3. 衛生福利部食品藥物管理署 - 藥品許可證查詢,檢自 https://info.fda.gov.tw/mlms/H0001.aspx(Feb.01.2021)
4. U.S. Food and Drug Administration, retrieved from https://www.fda.gov/drugs/biosimilars/biosimilar-product-information (Feb.01.2021)
5. EMA, European Medicines Agency , retrieved from https://www.ema.europa.eu/en/medicines/field_ema_web_categories%253Aname_field/Human/ema_group_types/ema_medicine/field_ema_med_status/authorised-36/ema_medicine_types/field_ema_med_biosimilar/search_api_aggregation_ema_medicine_types/field_ema_med_biosimilar (Feb.01.2021)
6. 健保用藥查詢,檢自https://www.nhi.gov.tw/QueryN/Query1.aspx (Feb.01.2021)
瀏覽人數 753081