中國大陸藥政改革自2015年揭開序幕,至今已有初步成果,亦於2017年6月加入ICH,展現出全面國際化的企圖心,預期中國在全球藥品研發價值鏈將佔有代表亞洲之重要地位。去年(2018)年底,更是兩項重大政策之驗收大限,其一為“上市許可持有人制度(Market Authorization Holder, MAH)”,為翻轉“以廠綁證”的顛覆性變革,該制度已納入《藥品管理法》修正,將以此為主軸,貫穿藥品全生命週期之管理,完善監管措施。另一項為仿製藥一致性評價,其配套採購措施,“4+7帶量採購”,實施結果,中選藥品藥價降價幅度,遠超過預期,震撼整個仿製藥產業。另鑒於中國大陸在臨床試驗監管方面之變革,加上其龐大的臨床受試者群體與市場,台灣或將面臨嚴峻競爭情勢。
你想掌握中國大陸最新法規進展、產業及醫院臨床試驗變革發展狀況嗎?法規學會特邀瀋陽藥科大學工商管理學院前院長武志昂教授、楊悅教授、清華大學醫學院附屬北京長庚醫院臨床試驗機構陳曉媛主任及天境生物科技有限公司申華瓊研發總裁,介紹法規修正重點、改革落實情況及後續影響,並與台灣法律、製藥產業及臨床試驗專家交流對談,將可協助台灣業者規劃在中國大陸市場發展之策略。
竭誠歡迎對中國大陸醫藥政策法規議題關切之會員及各界先進踴躍報名參加!
指導單位:衛生福利部食品藥物管理署
主辦單位:台灣醫藥品法規學會
時間:2019年8月16日(星期五) 09:00-17:00
地點:臺灣大學應用力學研究所1F國際會議廳
(詳細交通資訊請參考:
http://www.iam.ntu.edu.tw/intro/location )
報名流程:https://forms.gle/J5ekXui2SXmE1Wyz7 (僅限線上報名,毋須費用。)
報名截止日期:108年8月9日。
請儘早報名,額滿將提前停止受理線上報名。
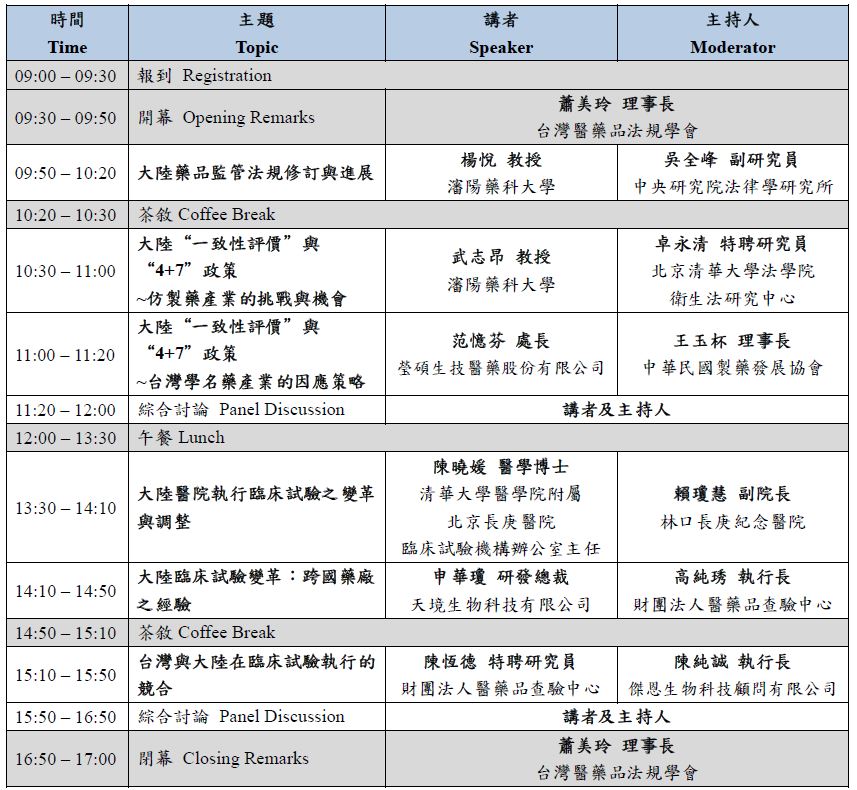
議程:
聯絡人:譚筱曉,TEL:(02)2747-3625,E-MAIL:
tsrap.class@gmail.com