近年來中國大陸醫療器材政策法規改革變動劇烈,更在國際醫療器材法規管理論壇(IMDRF)引領臨床評價(Medical Device Clinical Evaluation, MDCE)協調項目工作組,顯現中國大陸醫材法規更新之進展以及日趨顯著之國際影響力。
2020年12月21日,通過了《醫療器械監督管理條例》修正案,今年3月18日發布,強調強化企業、研製機構對醫療器械安全性有效性的責任,明確審批、備案程序,充實監管手段等。
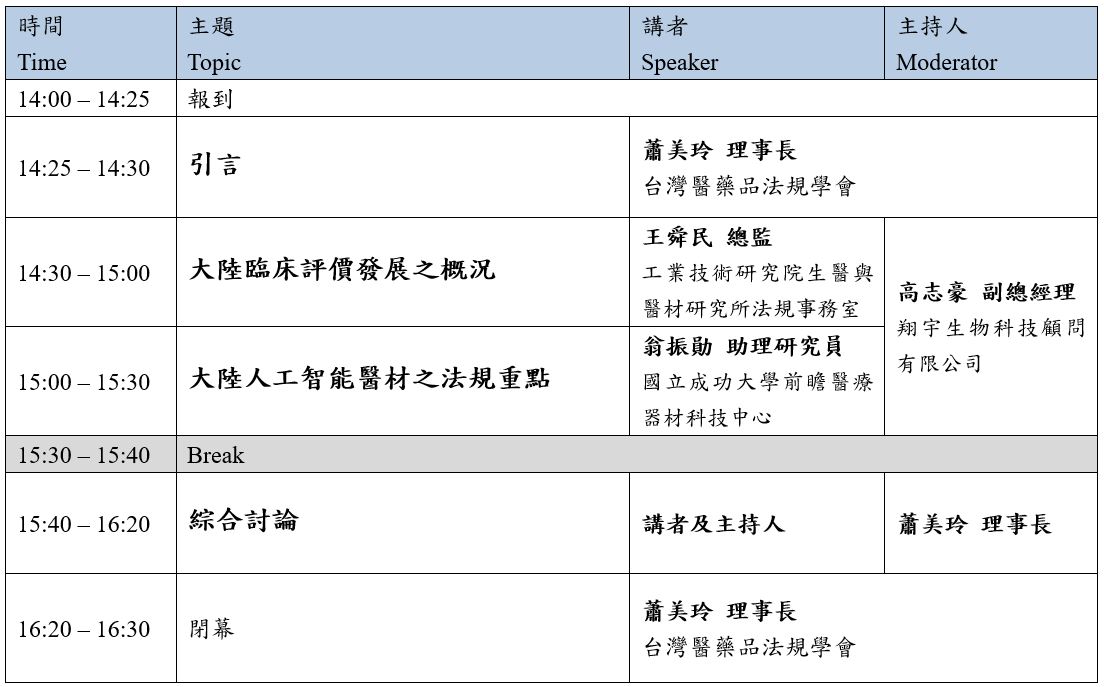
為使國內醫材業者能第一手瞭解中國大陸醫療器材法規趨勢發展,此次研討會特邀兩位專家,工業技術研究院生醫與醫材研究所法規事務室王舜民總監及國立成功大學前瞻醫療器材科技中心翁振勛助理研究員(產學組組長),將對於中國大陸醫療器械政策法規變革議題深入探討,包含介紹中國大陸《臨床評價》以及AI人工智能醫材之大陸現況進行演說。
主辦單位:台灣醫藥品法規學會
時間:2021年4月23日 (星期五) 14:00-16:30
視訊使用軟體:
google meet
議程:
※ 本學會保留講者及議程調整之權利,請以最新議程更新為準。
報名流程:
- 僅限線上報名( https://forms.gle/WswsNe82ASNtqE2a7 )。
- 即日起至額滿為止,欲報從速。
- 本次分享會為線上舉辦,採用「google meet 視訊軟體」,將把「會議連結」於會前提供至您在上述表單所預留之email。
費用:免費參加。
※ 請儘早報名,將為學會會員、食藥署及醫藥品查驗中心優先保留名額。
聯絡人:譚筱曉,TEL:(02)2747-3625,E-MAIL:
tsrap.class@gmail.com