感謝現場 120 多位先進的參與,也非常感謝王慧君執行長、高子翔副會長,以及食品藥物管理署張婷雅科長給予如此精闢的見解分享!
同時,涂醒哲董事長、馬海怡董事長及林滿玉院長等貴賓的蒞臨,從精準醫療、臨床試驗數據統計人力安排,討論到臨床試驗藥師送藥議題,學會持續關注法規政策趨勢與困境,期許擔任起產官學研討論交流平台的責任,為精進台灣生醫產業 ecosystem 貢獻心力!
環球生技月刊現場報導:
https://news.gbimonthly.com/tw/article/show.php?num=60804
以下演講資料,提供各界參考:
(1)
State of the Art in Drug Development and Health Authority Engagement 簡報資料
(2)
US/EU DCT regulation and development 簡報資料
COVID疫情催化下,伴隨著科技進化的推波助瀾,改變了醫療服務及醫藥產業的營運模式。在後疫情時代,法規監管機構做為民眾使用藥品的守門員,為確保民眾即時使用到安全、有效、具品質保證之醫藥品,法規規範與管理也進行了大幅度的調整。您想了解美國FDA與歐盟EMA,因應疫情,推行的新法規政策,以及面對這些新的法規規範,生技醫藥產業可能的因應策略與未來趨勢?同時,為回應疫情,數位醫療科技的相助帶來了臨床試驗的轉型,分散式臨床試驗(Decentralized Clinical Trial, DCT)將對未來的醫藥產業、醫療機構及民眾帶來什麼樣的變化?
台灣醫藥品法規學會非常榮幸邀請到長期深耘國際醫藥產業的王慧君執行長、Linus Kao副會長,以及食品藥物管理署張婷雅科長,分享對醫藥品監管法規趨勢的見解,及美、歐、台灣監管機構對DCT的政策措施等。竭誠歡迎對醫藥品法規及臨床試驗議題關切之會員及各界先進踴躍報名參加!
主辦單位:台灣醫藥品法規學會
會議時間:2023年7月29日(星期六)下午1點30分
會議地點:亞洲生技大會現場 504A會議室(南港展覽館一館5樓)
報名連結:
https://forms.gle/d6FGS6pg2AK5rSox5
議程:
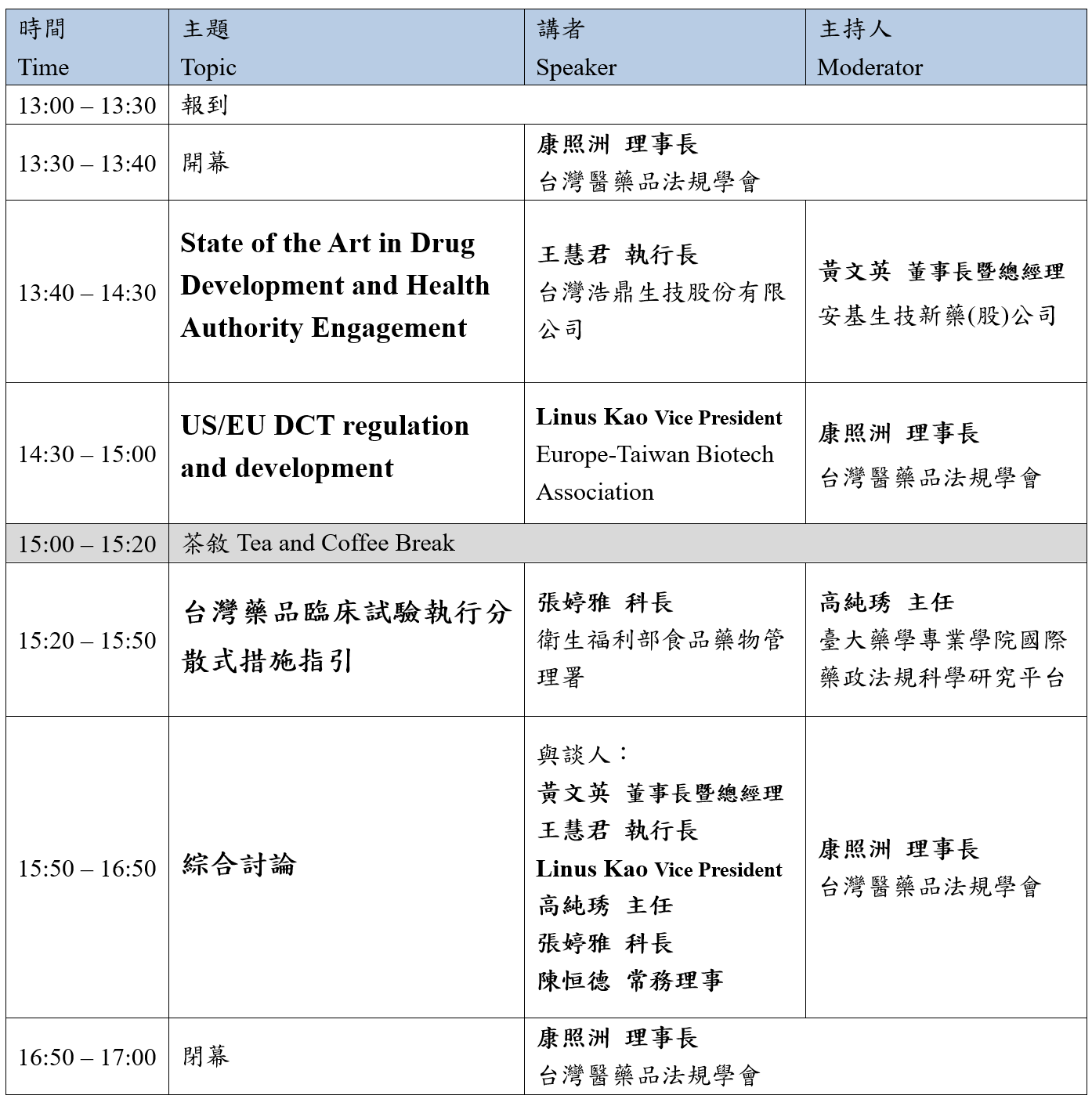
※ 本學會保留講者及議程調整之權利,請以最新議程更新為準。
聯絡人:鍾明翰、譚筱曉,TEL:(02)2747-3625,E-MAIL:
tsrap@tsrap.org.tw