版權為台灣醫藥品法規學會所有,公開引用請註明出處。
前言
台灣目前已經獲得健保給付之物相似性藥品共17個品項1,理論上這些藥品應可流通於醫療院所、由醫師開立處方、被病人所使用。根據2020年的報告顯示,目前生物相似性藥品之使用,僅有infliximab之生物相似性藥品使用有上升趨勢。2
國際上對於生物相似性藥品的接受度越來越高,審核生物相似性藥品皆有所成長。美國從2015年核准第一個生物相似性藥品後,迄今已有共31個不同的生物相似性藥品取得許可。英國脫歐後由MHRA獨立審查生物相似性藥品的上市許可,在最近又有了更新的審查規範。未來每期彙報皆會固定更新美國、歐盟、與台灣生物相似性藥品核准近況,並隨時注意國際動態,提供國際最新相關政策的報導。
生物相似性藥品建言書推出後已屆滿一年,這段期間,台灣醫藥品法規學會與其他相關單位,在生物相似性藥品認知教育與其他相關措施之實質進展為何?本次彙報將提供您最新的報告。
對於生物相似性藥品的免疫原性反應,本次選讀一篇系統性回顧文獻,了解目前生物相似性藥品轉換與引發抗體產生相關研究之最新概況。
本期彙報內容主要涵蓋以下四專欄:
一、國際核准上市近況:台灣及各國生物相似性藥品上市狀態更新
二、國際最新政策:英國最新生物相似性藥品政策介紹
三、生物相似性藥品建言書:一年來進展概況
四、專題報導:轉換參考藥品為生物相似性藥品之藥效、安全性及免疫原性:系統性回顧
一、國際核准上市近況:台灣及各國生物相似性藥品上市狀態更新1,2,3,4
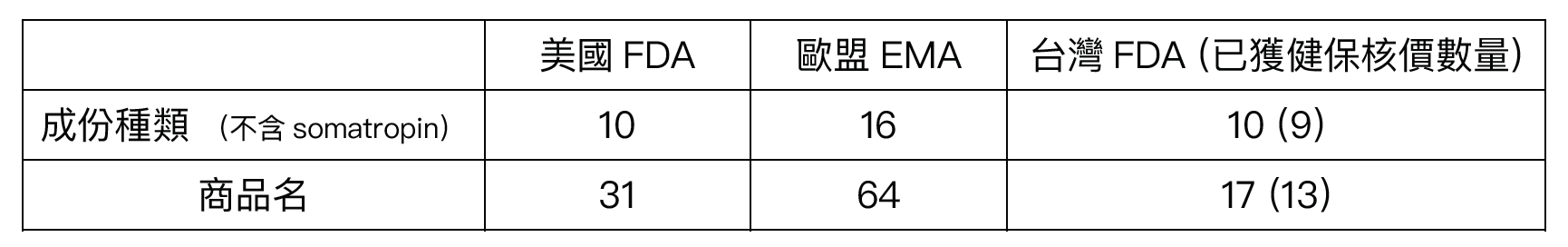
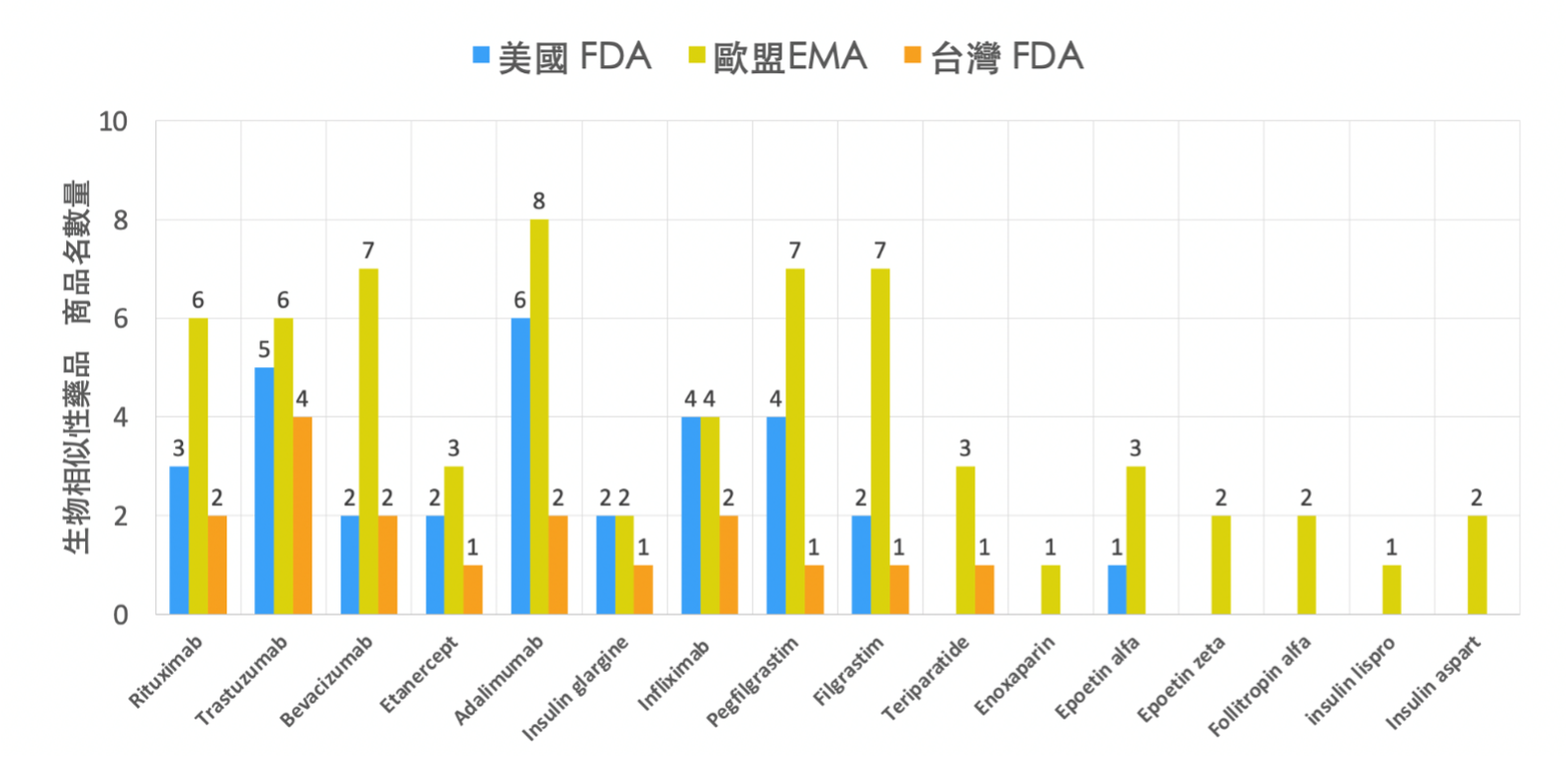
今年 (2021) 一月一日至七月一日為止,台灣食藥署已核准三個生物相似性藥品商品,其成分分別為teriparatide,bevacizumab與adalimumab,皆尚未獲得健保給付;歐盟今年共核准了三個成份,五個商品名,其中有三個商品之成份皆為bevacizumab,其餘為insulin aspart及adalimumab;美國FDA今年則尚未有新核准之生物相似性藥品。註1
表1. 目前美國FDA/歐盟EMA/台灣TFDA已獲得藥品許可證之生物相似性藥品(至2021.07.01)
圖1. 美國FDA / 歐盟EMA / 台灣FDA核准各成分之生物相似性藥品商品名數量統計
註1:各國統計皆不含somatropin。
二、國際最新政策:英國最新生物相似性藥品政策介紹
去年十月至十二月間,英國藥品與保健產品管理局 (the Medicines and Healthcare Products Regulatory Agency, MHRA) 發布英國脫歐後之生物相似性藥品審查指引,絕大多數審查內容與歐盟EMA相同,但對於可用於作為參考品之藥品具有更詳盡的規範,並刪減動物試驗,以及有條件地考慮減少不必要的的臨床比較性試驗(comparative efficacy/safety trial)。5
今年五月MHRA 再度發表此指引的修訂,這次修訂將確認性臨床試驗中的臨床藥動比較性試驗(comparative PK trial)歸為必要之試驗。然而,針對臨床療效比較性試驗(comparative efficacy trial),廠商則可提出不需臨床療效比較性試驗之詳細說明,闡明在功能性試驗、藥理學相關研究中,生物相似性藥品與參考藥品並無差異(如:驗證其活性成分在藥理作用或結合力上與參考品無差異),且這些相關研究已被證明可用以推論至臨床療效。 6
這項改變可能大幅縮短英國國民保健服務 (National Health Service, NHS) 取得生物相似性藥品的時間,甚至可能比舊制提早近一年,使英國政府得以節省數億英鎊之支出。7
三、生物相似性藥品建言書:一年來進展概況
本學會於去年六月提出生物相似性藥品政策建言,策略建議包含推廣生物相似性藥品認知教育、修訂核價機制與量價連動機制、制定收益共享機制、新增加計專款、簡化事前審查,放寬生物藥品給付規範,並建立本土臨床使用之真實世界數據等,如圖2所示。
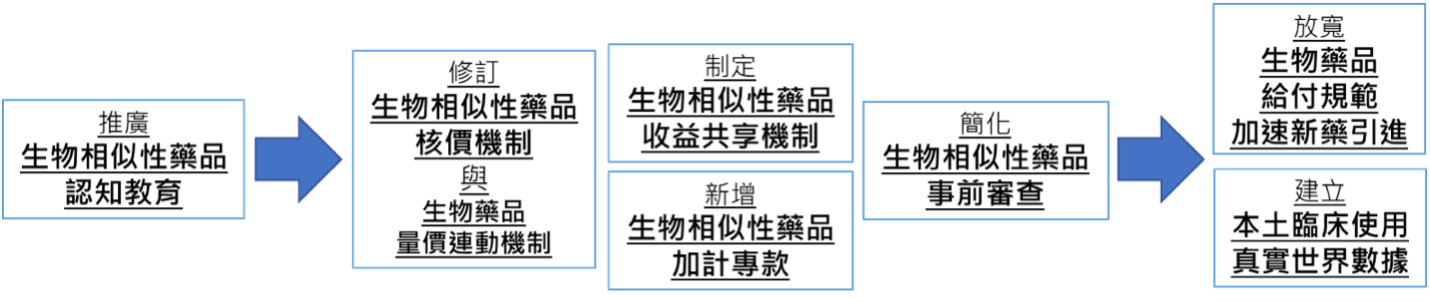
圖2. 生物相似性藥品推廣措施執行順序15
政策建言迄今已滿一年,目前之實質進展統整如下:
(一)、2020年6月30日 官方生物相似性藥品網頁8,9:我國衛福部食品藥物管理署、衛福部中央健康保險署皆有設置官方生物相似性藥品網頁。食藥署網頁設置生物相似性藥品專區,即提供生物相似性藥品定義、研發目標及核准上市審查要點,也提供相關仿單資訊、動畫衛教影片等9。健保網頁署供健保收載之生物相似性藥品清單,並連結其他國家(美國、歐盟、加拿大、澳洲)之政府生物相似性藥品專區。
(二)、2020年11月8日 第二屆台灣藥學聯合學術研討會,邀請到荷蘭學者Arnold Vulto談論荷蘭推動生物相似藥的相關措施,以及和信醫院藥劑科/國立陽明交大藥學系姜紹青副主任介紹生物相似性藥品政策建言。
(三)、2021年1月6日 成立生物相似性藥品健保政策工作小組:由部分區域醫院等級以上之主管藥師籌組工作小組,目的為了解醫院生物相似性藥品進藥政策、建立生物相似性藥品評估方法,並期待能在現有健保架構下,構思醫院可採行措施。
(四)、2021年2月 台灣醫藥品法規學會推出「生物相似藥推廣」網頁專區,提供「生物相似性藥品彙報」已有兩期,提供大眾更多關於生物相似性藥品的相關新知。
(五)、2021年3月27日 撥雲見日 迷思破解 生物相似性藥品法規研討會:今年三月本學會與臨床藥學會共同舉辦「撥雲見日 迷思破解 生物相似性藥品法規研討會」,提供臨床藥師對生物相似性藥品製造原理、法規審核架構及臨床實際運用之基本教育與認識,相關之討論已於前次彙報統整並公布於本學會生物相似藥推廣專區。11,13
(六)、2021年4月 27日 生物相似性藥品之定義修正意見:中華民國製藥發展協會建議食藥署將生物相似性藥品之定義正名且統一,以避免有誤導民眾之疑慮。詳細報導請見前一次彙報。13
(七)、2021年5月 財團法人中華景康藥學基金會於今年推出景康基金會-生物相似藥專區,內有「生物相似性藥民眾認知宣導計畫」,目的在於提升大眾對生物相似性藥的認知,藉由邀請多位不同的醫、藥、學者及病友團體進行相關訪問,並公布於基金會網頁、臉書粉絲專頁、網路新聞平台等,提供一般社會大眾更正確的生物相似性藥品知識。相關的報導目前已有三篇,其詳細資訊可於景康基金會-生物相似藥專區檢視。10
(八)、2021年5月24日 台灣癌症基金會「癌友須知 生物相似藥」衛教網頁修訂:財團法人台灣癌症基金會早在去年九月中旬即架設「癌友須知 生物相似藥」衛教網頁12,內容針對癌症病友可能遇到的生物相似性藥品議題作詳盡地闡述,並提供精美的懶人包、衛教動畫影片等教育推廣素材,惟某些資訊內容仍可能造成癌友之疑惑。今年五月,本學會委由和信醫院藥劑科/國立陽明交大藥學系姜紹青副主任與財團法人台灣癌症基金會攜手合作,就網頁較可能引起誤解之資訊進行全面的檢視與調整。
(九)、2021年7月6日 生物相似藥功能委員會成立:產業界在建言書推出後逐漸凝聚共識,於今年三月在台灣生物產業發展協會之下籌組生物相似藥功能委員會(Taiwan Bio Biosimilar Functional Committee , TBBFC),由六家生物相似性藥品廠商共同組成,目的為與其他相關學會合作,積極展開與政府相關部門的對談,以達到台灣生物相似性藥品普及化。在推動生物相似性藥品的政策方面,具有縱向、多功能的溝通及執行能力。其主要工作方向有以下三大要點:
- 政策推動:針對食藥署、健保署、主要醫院端進行生物相似性藥品政策推動溝通,並尋求與政府合作,建置生物相似性藥品相關的教育計畫。
- 教育推廣:以TBBFC為平台提升生物相似性藥品大眾正確認知,及時澄清錯誤訊息,建立生物相似性藥品闢謠專區。
- 外部合作交流:與相關醫學會及病友團體建立正向合作關係。
TBBFC於今年7/19-7/28積極參與2021 Bio Asia 亞洲生技大展,於線上展場進行專區設展14,年底時也將參與實體展示並提供媒體公開採訪。未來將持續擴大影響力,全力推動生物相似性藥品的相關發展。
(十)、2021年7月16日 台灣醫藥品法規學會將生物相似性藥品政策建言書翻譯為英文,並公布於網頁上,以提供全球相關學者對台灣生物相似性藥品政策建言的認識。
(十一)、2021年8月6日 由本學會舉辦「推動生物相似性藥品使用論壇」,邀請產、官、學各界之主管機關、專家、學者就本學會提出之政策建言,檢視一年來政策建言所參考國家及美國在生物相似性藥品政策之精進,學會後續推動之工作及政府對建言策略之採行概況。
回顧過去一年,建言書提出的七大建議中15,以生物相似性藥品之認知教育進展最為顯著,不論產、官、學界都有發揮正面影響力,協助台灣醫療專業人員、病人、一般民眾取得更正確之生物相似性藥品知識,並校正易引起誤導之資訊。未來有待各界持續積極合作,共同推動相關的教育與知識普及,可進一步針對醫師、藥師等醫療專業人員進行更深化的教育,包括在醫療人員大學教育強化生物製劑(含生物相似性藥品)之教育、由政府單位與相關醫學會合作,提供醫師專門之教育課程,以及推動醫療人員持續教育計畫等。
健保署是否採行建言提出之鼓勵策略,值得關注。綜觀一年來,政府除透過原已建立之網站,提供簡要的資訊外,目前尚待進一步參考建言,採行健保相關鼓勵措施。本學會在今年八月舉辦之「推動生物相似性藥品使用論壇」,即邀請食藥署、健保署主關機關與相關專家、學者及產業界代表,對台灣的生物相似性藥品政策進行觀點與意見之深度交流,未來有待這些相關之討論持續發酵、成熟。而生物相似性藥品健保政策工作小組研擬相關政策之執行細節也將持續進行。另外,生物相似藥功能委員會也將持續強化與食藥署、健保署之有效溝通,以利相關政策之推動。
四、專題報導:轉換參考藥品為生物相似性藥品之藥效、安全性及免疫原性:系統性回顧
本學會收集各界資訊,發現許多醫療專業人員在提及生物相似性藥品時,對於轉換 (switching) 是否會產生免疫原性具有疑慮。本次彙報特地選讀一篇臨床上轉換研究(switching study)之系統性回顧,未來如需進行特定生物相似性藥品之免疫原性相關文獻搜索與閱讀時,本篇中提及的要點可提供各界參考。
(一)、文獻主題: 轉換參考藥品為生物相似性藥品之藥效、安全性及免疫原性:系統性回顧 The Efficacy, Safety, and Immunogenicity of Switching Between Reference Biopharmaceuticals and Biosimilars: A Systematic Review16
(二)、文獻介紹:
2020年在SCIE期刊Clinical Pharmacology & Therapeutics 發佈,旨在針對臨床上對病人進行參考藥品與生物相似性藥品之轉換議題(療效、安全、免疫原性),進行系統性的文獻回顧。以下則著重免疫原性的討論。
(三)、文獻重點:
- 參考生物與生物相似性藥品為立體結構高度相似,因此其抗原表位(epitope)也可能不盡相同。這些差異性可能導致人體產生不同的抗藥抗體。產生抗藥抗體後,可能導致藥物失去療效或引發其他免疫相關之不良反應,進而造成藥品效力與安全性問題。
- 過去的文獻17指出,會影響人體免疫原性的因素如:不同的人體基因組成、疾病、藥品蛋白質種類、蛋白分子的組成形態、藥品的劑量、給藥途徑、頻率、治療時間長短、藥品純度、儲放條件等。
- 本研究整理所有收錄文獻之研究設計共有七種,無法進行統合分析,在評讀研究時也要小心,注意研究設計的穩健度、敏感度、比較之生物相似性藥品、病患收錄條件等資訊。
- 本次收集之研究大多是針對Infliximab 參考藥品轉換為生物相似性藥品CT-P13 之研究 (100/178)。
- 單次由參考藥品轉換為生物相似性藥品之絕大多數研究中,沒有可靠的數據顯示此轉換與免疫原性、安全性、效力之問題有關。
- 要避免反安慰劑效應,必須仰賴醫療專業人員對生物相似性藥品的了解,提供病人全面且正確的衛教資訊,並能使病人、醫療人員共同參與治療決策。
- 罕見的免疫原性反應、嚴重不良反應,有賴生物相似性藥品上市後監測系統的警訊偵測。
Reference:
- 衛生福利部食品藥品管理署 - 藥品許可證查詢,檢自 https://info.fda.gov.tw/mlms/H0001.aspx (Jul.01.2021)
- U.S. Food and Drug Administration, retrieved from https://www.fda.gov/drugs/biosimilars/biosimilar-product-information (Jul.01.2021)
- EMA, European Medicines Agency , retrieved from https://www.ema.europa.eu/en/medicines/field_ema_web_categories%253Aname_field/Human/ema_group_types/ema_medicine/field_ema_med_status/authorised-36/ema_medicine_types/field_ema_med_biosimilar/search_api_aggregation_ema_medicine_types/field_ema_med_biosimilar (Jul.01.2021)
- 健保用藥查詢,檢自https://www.nhi.gov.tw/QueryN/Query1.aspx (Jul.01.2021)
- Guidance on the licensing of biosimilar products, the Medicines and Healthcare products Regulatory Agency, UK, https://www.gov.uk/government/publications/guidance-on-the-licensing-of-biosimilar-products/guidance-on-the-licensing-of-biosimilar-products (May. 06.2021)
- UK releases post-Brexit biosimilar guidelines, GENERICS AND BIOSIMILAR INITIATIVE, https://www.gabionline.net/guidelines/UK-releases-post-Brexit-biosimilar-guidelines (Nov.06.2020)
- UK’s MHRA updates its guidance on licensing biosimilars, GENERICS AND BIOSIMILAR INITIATIVE, https://www.gabionline.net/guidelines/uk-s-mhra-updates-its-guidance-on-licensing-biosimilars (Jul.16.2021)
- 生物相似性藥品專區, 衛生福利部中央健康保險署全球資訊網, https://www.nhi.gov.tw/Content_List.aspx?n=BB66BBDCAB4C3DFC&topn=5FE8C9FEAE863B46 (Feb.08. 2021)
- 生物相似性藥品專區, 衛生福利部食品藥品管理署全球資訊網,https://www.fda.gov.tw/TC/siteContent.aspx?sid=11262 (Jun.30.2020)
- 生物相似性藥民眾認知宣導計畫, 財團法人中華景康藥學基金會https://www.ckf.org.tw/policy.php (Jul.01.2021)
- 生物相似藥推廣專區, 台灣醫藥品法規學會 https://tsrap.org.tw/news.php?category=2 (Jul.15.2021)
- 癌友須知 生物相似藥 衛教網頁, 財團法人台灣癌症基金會, https://biosimilar.canceraway.org.tw (Jul.15.2021)
- 台灣醫藥品法規學會 生物相似性藥品彙報Taiwan Biosimilars Update 第二期, https://tsrap.org.tw/medicine_detail.php?id=529 (Mar.25.2021)
- Bio Asia Taiwan 19-28, July Online Exhibition, https://www.chanchao.com.tw/bioasiataiwan/onlineexpo/Landing (Jul.16.2021)
- 台灣醫藥品法規學會 生物相似性藥品政策建言, Ch 9- 總結與建議, p44 https://tsrap.org.tw/law-info_article-1.php?id=407 (Jun.01.2020)
- Barbier L, Ebbers HC, Declerck P, Simoens S, Vulto AG, Huys I. The Efficacy, Safety, and Immunogenicity of Switching Between Reference Biopharmaceuticals and Biosimilars: A Systematic Review. Clinical Pharmacology & Therapeutics 2020;108:734-55.
- Schellekens, H. Immunogenicity of therapeutic proteins: clinical implications and future prospects. Clin. Ther. 24, 1720–1740 (2002).