版權為台灣醫藥品法規學會所有,公開引用請註明出處。
生物製劑的使用量與花費在全球各地皆逐年升高,台灣也不例外。生物相似性藥品的使用是各國維持藥品市場競爭性的一重要關鍵。關於如何鼓勵使用生物相似性藥品,以創造市場競爭性,在本期彙報中,我們將介紹台灣未來的可能做法。除了彙整美國、歐盟及台灣之生物相似性藥品核准概況、2022年健保署於公開場合所提出最新之生物相似性藥品使用量統計、可能節省金額預估,及目前正著手規劃之的生物相似性藥品使用鼓勵措施等,提供參考。
本期彙報內容主要涵蓋以下三專欄:
一、國際核准上市近況:台灣及各國生物相似性藥品上市數量
二、2022年健保署生物相似性藥品使用數據與預估節省花費
三、生物相似性藥品相關之健保鼓勵措施概覽
一、國際核准上市近況:台灣及各國生物相似性藥品上市狀態更新1,2,3,4
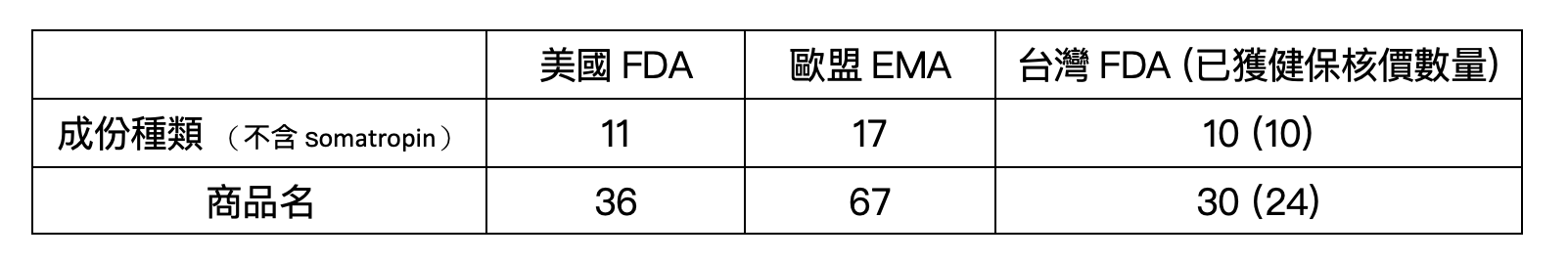
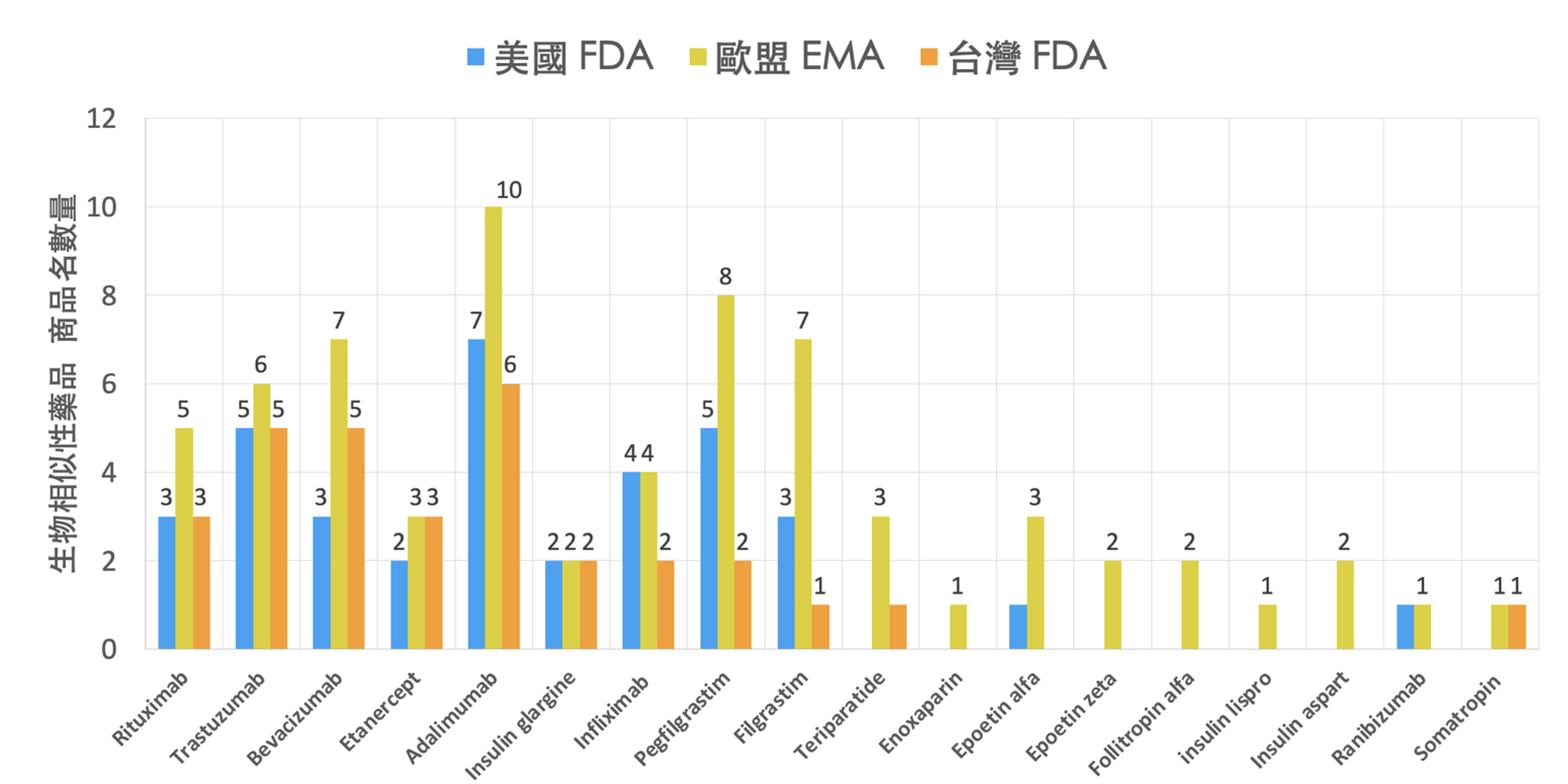
至2022年 6月1日止,台灣衛福部食藥署已經核准30個不同的生物相似性藥品。註1若以其成分計算,台灣已有10個成分具有生物相似性藥品,包含adalimumab, bevacizumab, etanercept, filgrastim, infliximab, insulin glargine, pegfilgrastim, rituximab, teriparatide, trastuzumab,其中以adalimumab具有6個不同生物相似性藥品為最多,其次為trastuzumab及bevacizumab各有5個不同廠牌。目前已獲健保給付的adalimumab生物相似性藥品共有5個廠牌、trastuzumab有4個廠牌,而bevacizumab則有3個廠牌。
整體而言,生物相似性藥品取得健保給付之速度有加快的趨勢,如圖1所示,從取得藥品許可證至取得健保給付所花費的時間逐年降低,2017年之平均花費天數為419天,目前則降低至平均約276天即可取得健保核價。根據今年4月28日由台北市進出口商業同業公會與中華民國西藥代理商業同業公會共同舉辦之「我國生物相似藥品發展願景」研討會中,健保署醫審及藥材組戴雪詠前組長之報告,目前健保署收載生物相似性藥品以新品項辦理,不須提專家會議討論,可有效縮短三個月時間。5
統整台灣、歐盟及美國之生物相似性藥品上市狀況,如表1及圖2所示。可觀察到歐盟核准數量仍為最高,目前已核准67個不同的生物相似性藥品,其中enoxaparin、epoetin-zeta、follitropin-alpha、Insulin lispro、insulin aspart在歐盟被核准,而尚未在美國或台灣上市。Ranibizumab是目前最新近被美國與歐盟核准之生物相似性藥品,為一種拮抗人類血管內皮生長因子之藥品,可用於治療血管新生型年齡相關的黃斑部病變。另外,可觀察到美國未有teriparatide之生物相似性藥品上市。
圖1. 台灣生物相似性藥品歷年取得健保給付所需平均天數)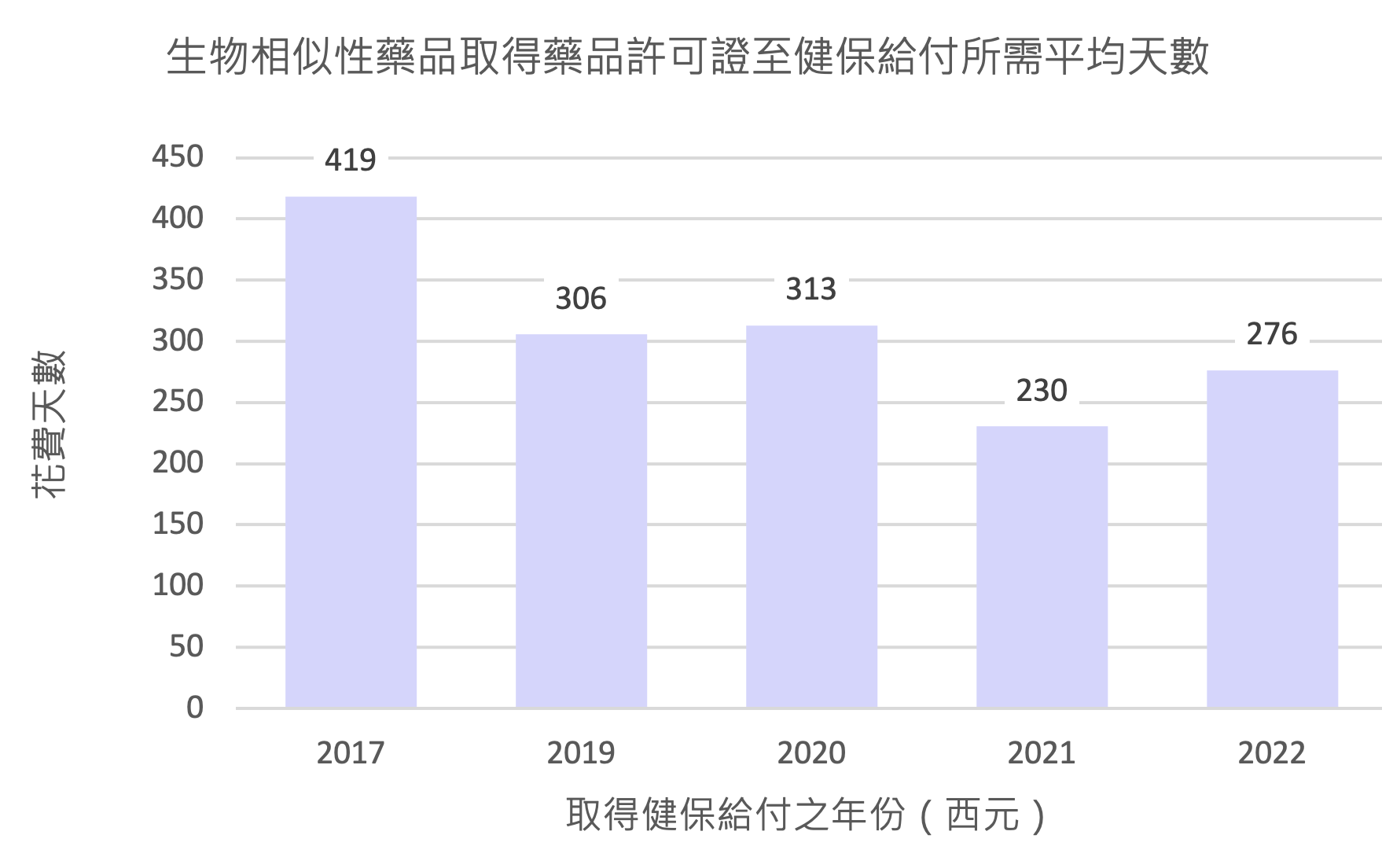
表1. 目前美國FDA/歐盟EMA/台灣TFDA已核給藥品許可證之生物相似性藥品(至2022.06.01)
圖2. 美國FDA / 歐盟EMA / 台灣FDA核准各成分之生物相似性藥品商品名數量統計
註1:生物相似性藥品之核准數量皆以不同商品名計算。
註2:各國統計皆不含somatropin。
二、2022年健保署生物相似性藥品使用數據與預估節省花費
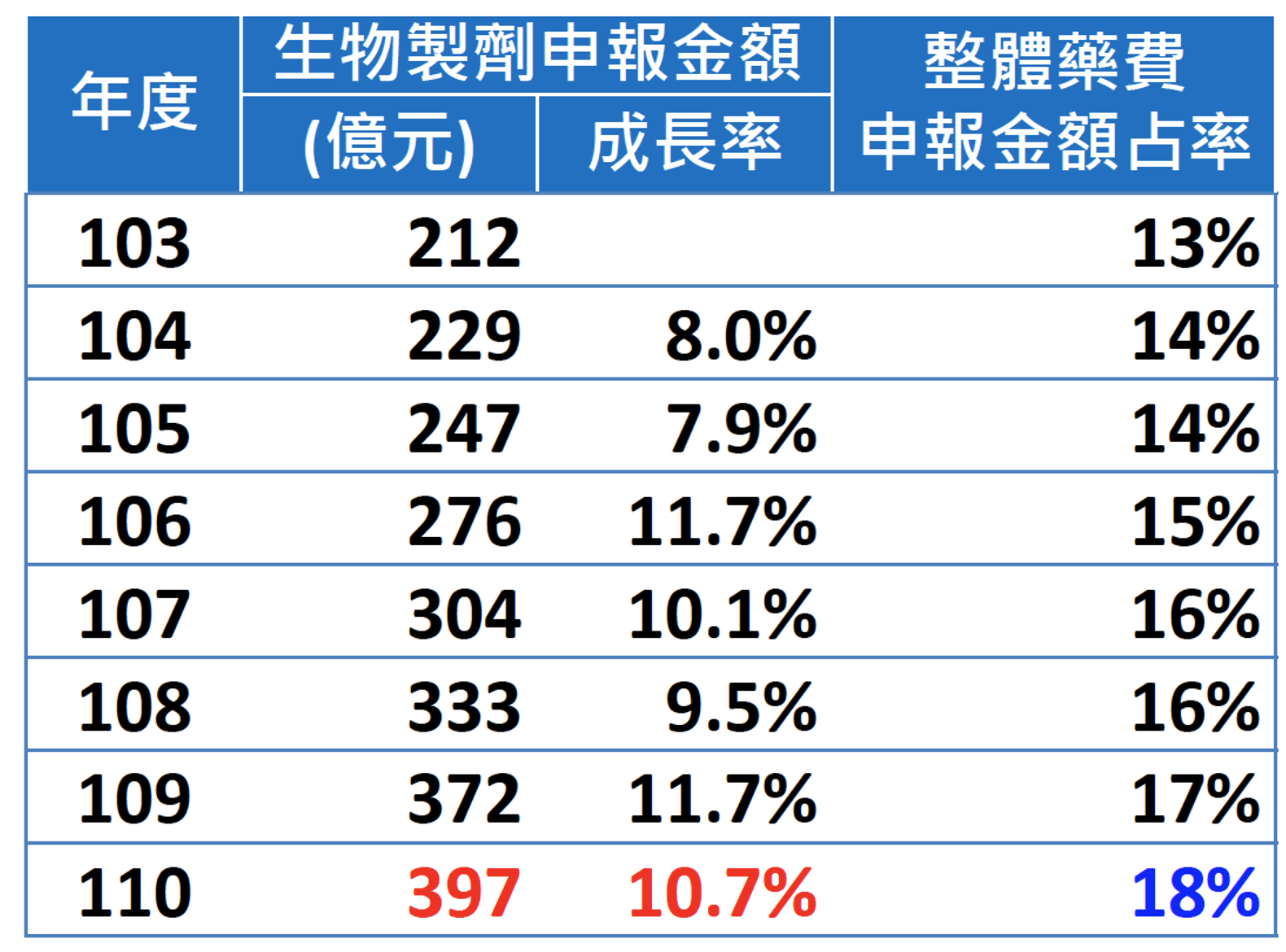
2022年4月9日 由國家衛生研究院、衛生福利部中央健康保險署、國民健康署及 聯合報共同主辦之「2022癌症高峰論壇:無畏・癌症教會我的事」中,衛生福利部中央健康保險署署長李伯璋之報告6,目前健保給付生物製劑之金額每年持續攀升,年成長率約7.9~11.7%,目前已佔整體藥費之18%,如表2所示。
表2. 歷年健保給付生物製劑之金額統計6
生物相似性藥品屬於生物製劑之一類,因藥價較原廠參考藥品低,而其療效與安全性與原廠參考藥品並無臨床上有意義的差異,若使用得當,應可節省生物製劑之健保支出。然而,根據4月28日「我國生物相似藥品發展願景」研討會中,健保署醫審及藥材組戴雪詠前組長之報告資料,生物相似性藥品之實際使用情形仍有很大進步空間, 26款生物相似性藥品註3,除了infliximab註4與somatropin註5以外,分組占比仍僅在0~5.3%之間,如表3所示。5
表3. 生物製劑及其生物相似性藥品給付現況5
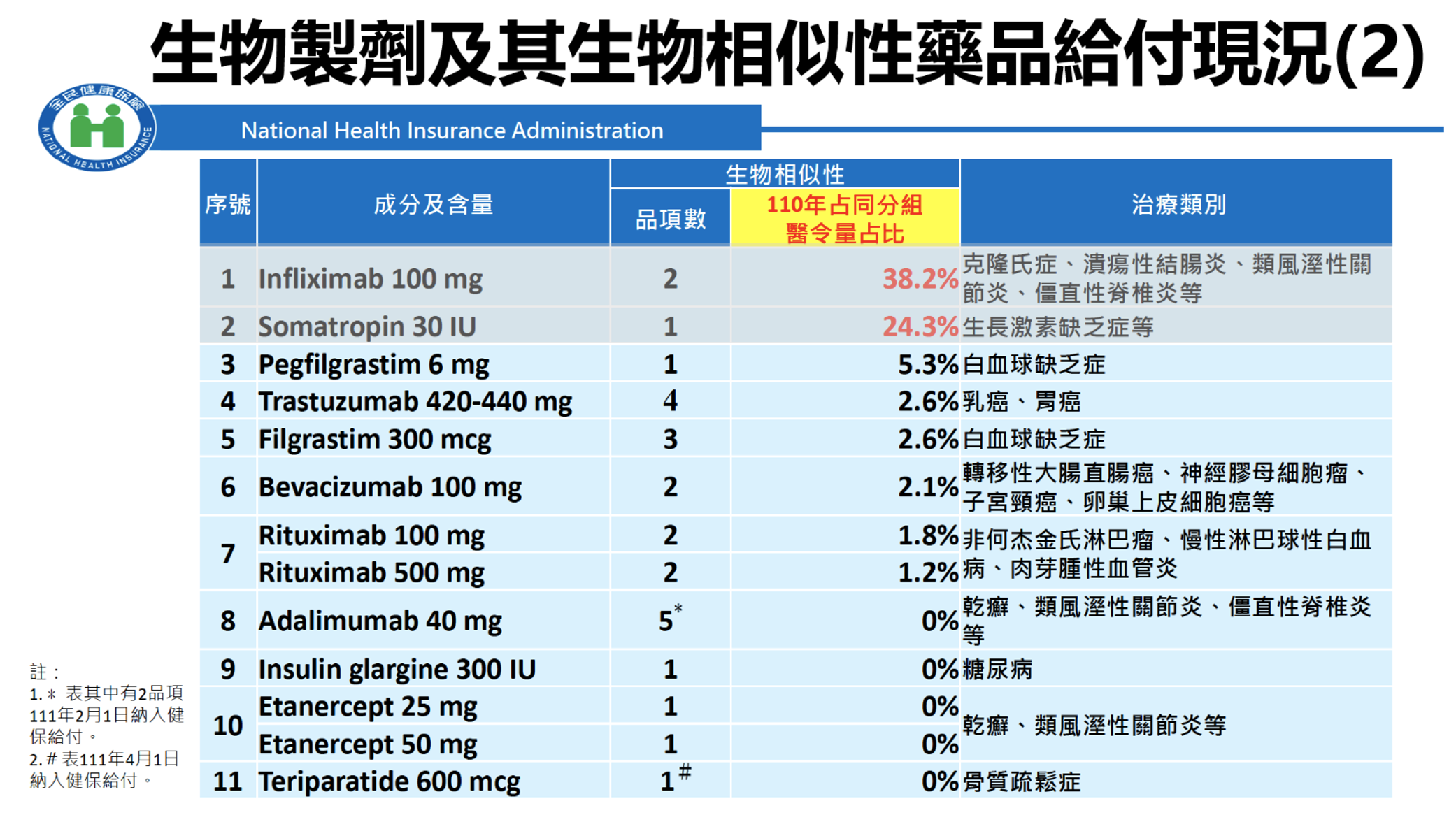
註3: 此表格不包含生物相似性藥品 Ruxience (Rituximab)。
註4:Somatropin 之生物相似性藥品上市時視同學名藥,目前該成分已統一核價,其價格與原廠藥品同價,生物相似性藥品分組佔比達24.3% 。
註5:Infliximab之原廠藥品Remicade 於2015/09/01獲得藥品許可證後,第一款生物相似性藥品Remsima也迅速於2016/12/22獲得藥品許可證。在健保核價時間點上,原廠藥品Remicade核價時間為2017/05/07,第一款生物相似性藥品Remsima則在2017/10/01也快速獲得健保核價,顯示原廠藥與生物似性藥品幾乎是同一時間進入台灣市場。
生物相似性藥品佔比偏低的可能原因推測如下:第一,多數醫學中心對於生物相似性藥品之進藥規範可能仍較為嚴格7;第二,根據去年11月6日第三屆台灣藥學聯合學術研討會中,台北市立聯合醫院聯合資材中心郭垂文主任及高雄榮民總醫院藥劑部李建立主任所分享之生物相似性藥品相關健保策略與臨床經驗,顯示具有總額管制之醫院(健保業務分區之北區、高屏區醫院)較有誘因進用生物相似性藥品,而其餘無總額管制之醫院,目前無明顯之誘因促其使用。
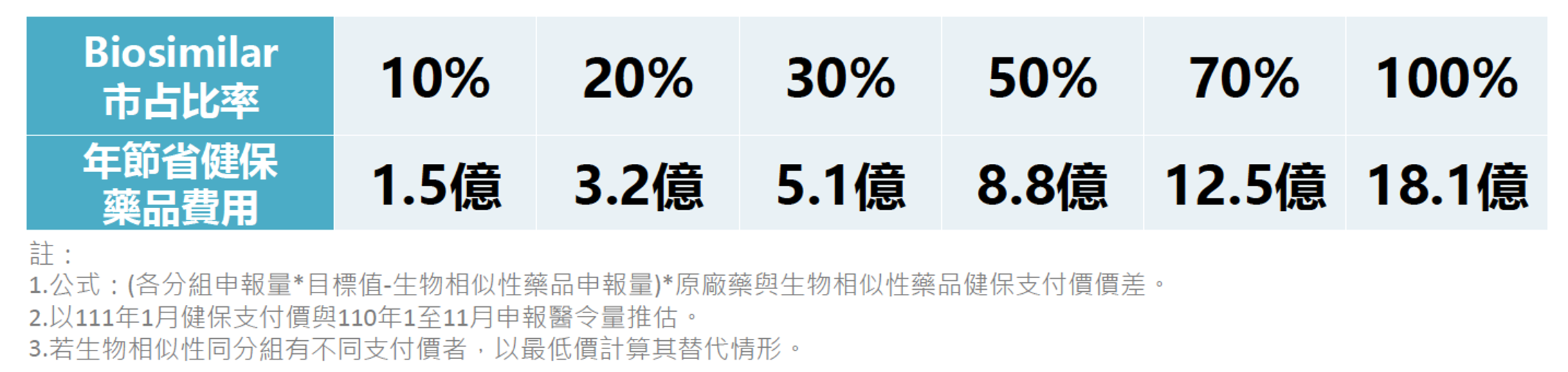
在生物相似性藥品可節省之藥品費用預估上,4月28日「我國生物相似藥品發展願景」研討會中,健保署醫審及藥材組戴雪詠前組長也以健保資料庫進行之最新估算,請參見表4。若能成功以生物相似性藥品逐步取代原廠參考藥品之現有市場,每年將可為健保署節省1.5~18.1億台幣之藥費支出,這些節省下來的藥費或可幫補給付新藥的預算或作為其他用途,增進健保資源的有效利用。此外,未來若有更多生物相似性藥品獲醫院採用,此節省金額還可逐步上升。
表4. 生物相似性藥品市佔比率預估可節省之健保費用5,6
三、生物相似性藥品之最新健保鼓勵措施概覽
根據2022年4月9日「2022癌症高峰論壇:無畏・癌症教會我的事」中,衛生福利部中央健康保險署署長李伯璋報告,為了增進生物相似性藥品之使用,目前已著手規劃生物相似性藥品的三大健保鼓勵措施:免除事前審查、放寬使用期限、擴增給付規定,詳細的全篇演講及報導線上仍可收看。8 李署長在受訪時也提到,「健保署除推動生物相似藥免除事前審查、放寬使用期限,也擴增給付規定,例如放寬年齡,但病人數可能因此變多,對財務也有衝擊影響,不過整體而言,推動生物相似藥是健保署努力的目標」。8
健保署醫審及藥材組戴雪詠前組長也曾於4月28日「我國生物相似藥品發展願景」研討會中提到,在擴增給付規定方面,或可導入療程包裹給付的概念。5 所謂的包裹式給付,是在固定的包裹給付價格下,交由市場自由選擇最具效益之治療藥品組合。台灣在包裹式給付的案例,可參考目前C肝新藥健保給付執行計畫中之給付方式,健保給付每位C型肝炎病患約18萬之藥品費用,交由醫院與病患決定使用哪一種療程的C型肝炎用藥。包裹式給付若可適用於生物相似性藥品之相關適應症,可強化生物相似性藥品之市場競爭性。生物相似性藥品之初始核價已比原參考藥品低,在包裹式給付的條件下,使用生物相似性藥品將可用相同的花費而仍延長療程時間。
健保署最新的藥品給付規定顯示,生物相似性藥品Rixathon(成分名rituximab)已取得慢性淋巴球性白血病的部分擴增給付規定。本彙報整理目前市面上已有生物相似性藥品之成分,在健保藥品給付規範中明列的給付適應症、事前審查及療程限制之概要9供各界參考,如下表5所示。
不論是免除事前審查、放寬使用期限,或者擴增給付規定,期待健保署能重視並利用生物相似性藥品在市場上的角色,儘速落實上述鼓勵措施,穩建地創造市場競爭機制,藉此提升健保整體之效益。
表5 已有生物相似性藥品成分之健保給付規範概要9
| 成份 |
健保給付適應症 |
事前審查 |
療程限制 |
| Trastuzumab |
早期乳癌 |
需要 |
每24週審查一次
總療程一年 |
| 轉移性乳癌 |
需要 |
每24週審查一次 |
| 轉移性胃癌(IV劑型) |
需要 |
每24週審查一次 |
| Bevacizumab |
轉移性大腸直腸癌 |
需要 |
總療程36週 |
| 神經膠母細胞瘤 |
需要 |
每12週審查一次 |
| 卵巢上皮細胞、輸軟管、原發性腹膜癌 |
需要 |
每16週審查一次
總申請療程限15個以內 |
| 持續性、復發性或轉移性子宮頸癌 |
需要 |
每16週審查一次 |
| Rituximab |
CD20抗原陽性之B瀰漫性大細胞非何杰金氏淋巴瘤、未經治療之和緩性(組織型態為濾泡型)B細胞非何杰金氏淋巴瘤 |
不需要 |
無 |
| 復發或對化療有抗性之低惡度B細胞非何杰金氏淋巴瘤 |
需要 |
無 |
| 有條件之濾泡性淋巴瘤誘導後維持治療 |
需要 |
條件限制下,限用8劑,
最多不超過2年 |
| 慢性淋巴球性白血病 |
需要 |
初次申請最多6個療程,
再次申請以3個療程為限。
111.06.01修訂之生物相似性藥品放寬規範:
Rixathon用於Rai Stage I/II慢性淋巴球性白血病不受「需經過一種標準的烷化基劑治療無效或病情惡化,且CD20陽性細胞須大於50%」及「CD20陽性細胞須大於50%」限制,僅須符合具CD20陽性細胞即可使用;用於復發或頑固性的CD20陽性慢性淋巴球性白血病不受「CD20陽性細胞須大於50%」限制,僅須符合具CD20陽性細胞即可使用。 |
| 肉芽腫性血管炎、顯微多發性血管炎 |
需要 |
每次申請以4週療程為限 |
| 成人類風濕性關節炎 |
需要 |
第21週評估療效,
重複療程需間隔24週以上 |
| 成人中度至重度尋常性天疱瘡(PV) |
需要 |
無 |
| Adalimumab |
2歲以上小兒
活動性多關節幼年型慢性關節炎 |
需要 |
每6個月審查一次 |
| 成人類風濕關節炎 |
需要 |
初次使用半年後,每3個月審查一次
兩年治療且已達疾病緩解超過6個月須減量,減量1年後須暫緩續用 |
| 僵直性脊椎炎 |
需要 |
每12週審查一次 |
活動性乾癬性關節炎-乾癬性周邊關節炎
活動性乾癬性關節炎-乾癬性脊椎病變 |
需要 |
每12週審查一次 |
| 乾癬 |
需要 |
第12週時須先評估療效,
其後每6個月審查一次
使用2年後符合PASI≦10 需暫緩續用 |
| 克隆氏症 |
需要 |
初次審核6週用量,
後續每24週審查一次
總療程28劑 |
| 潰瘍性結腸炎 |
需要 |
初次審核6週用量,
後續最長24週審查一次
總療程最高48週 |
| 小兒非感染性葡萄膜炎 |
需要 |
每24週審查一次 |
| Infliximab |
僵直性脊椎炎 |
需要 |
每12週審查一次 |
| 成人類風濕關節炎 |
需要 |
初次審核22週用量,
後續每16週審查一次 |
| 克隆氏症 |
需要 |
初次審核6週用量,
後續每16/24週審查一次
總療程8劑 |
| 潰瘍性結腸炎 |
需要 |
初次審核6週用量,
後續最長24週審查一次
總療程最高40週 |
| Etanercept |
4歲以上小兒
活動性多關節幼年型慢性關節炎 |
需要 |
每6個月審查一次 |
| 成人類風濕關節炎 |
需要 |
初始使用半年後,每3個月審查一次
兩年治療且已達疾病緩解>6個月須減量,
減量1年後須暫緩續用 |
| 僵直性脊椎炎 |
需要 |
每12週審查一次 |
活動性乾癬性關節炎-乾癬性周邊關節炎
活動性乾癬性關節炎-乾癬性脊椎病變 |
需要 |
每12週審查一次 |
| 乾癬 |
需要 |
第12週時須先評估療效,
其後每6個月審查一次
使用2年後符合PASI≦10 需暫緩續用 |
| Teriparatide |
骨質疏鬆症 |
不需要 |
不得超過18支,須於兩年內使用完畢 |
| Insulin glargine |
糖尿病 |
不需要 |
無 |
| Pegfilgrastim |
白血球缺乏症 |
不需要 |
無 |
| Filgrastim |
白血球缺乏症 |
不需要 |
無 |
Reference:
- 衛生福利部食品藥品管理署 - 藥品許可證查詢,檢自 https://info.fda.gov.tw/mlms/H0001.aspx (Jun.16, 2022)
- U.S. Food and Drug Administration, retrieved from https://www.fda.gov/drugs/biosimilars/biosimilar-product-information (Jun.16, 2022)
- EMA, European Medicines Agency , retrieved from https://www.ema.europa.eu/en/medicines/field_ema_web_categories%253Aname_field/Human/ema_group_types/ema_medicine/field_ema_med_status/authorised-36/ema_medicine_types/field_ema_med_biosimilar/search_api_aggregation_ema_medicine_types/field_ema_med_biosimilar (Jun.16, 2022)
- 健保用藥查詢,檢自https://www.nhi.gov.tw/QueryN_New/QueryN/Query1 (Jun.16, 2022)
- 我國生物相似性藥品健保給付政策現況與願景 衛生福利部中央健康保險署 – 醫審及藥材組 戴雪詠前組長, 我國生物相似藥品發展願景 研討會 (Apr.28, 2022)
- 新藥科技對於健保財務的衝擊與因應 衛生福利部中央健康保險署 - 署長李伯璋 , 2022癌症高峰論壇:無畏・癌症教會我的事 (Apr.09, 2022)
- 台灣醫藥品法規學會 生物相似性藥品彙報Taiwan Biosimilars Update 第二期, https://tsrap.org.tw/medicine_detail.php?id=529 (Mar.25, 2021)
- 2022癌症高峰論壇:無畏・癌症教會我的事「新藥科技對於健保財務的衝擊與因應」全篇演講內容與報導:https://health.udn.com/health/story/122421/6226632 (Apr.09, 2022)
- 全民健康保險藥物給付項目及支付標準 衛生福利部中央健康保險署 (Jun.20, 2022)